Spis treści
- Enzymy: budowa
- Regulacja aktywności enzymów
- Enzymy: rola
- Enzymy: nazewnictwo
- Enzymy a medycyna
- Choroby wynikające z dysfunkcjonalnych enzymów
- Enzymy: wykorzystanie w diagnostyce
- Enzymy, a leczenie
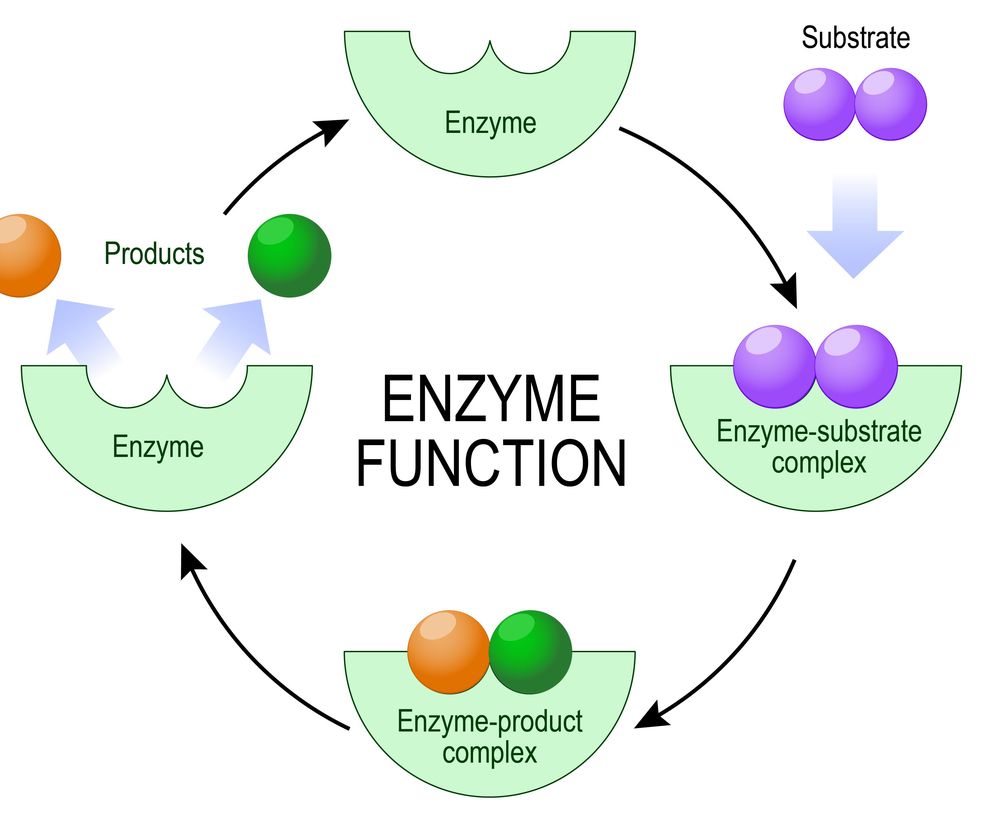
Enzymy to cząsteczki białkowe, które przyspieszają lub wręcz umożliwiają zachodzenie przeróżnych reakcji chemicznych w organizmach żywych, w tym w ciele człowieka.
Z chemicznego punktu widzenia są to katalizatory, czyli cząstki intensyfikujące zachodzenie reakcji, ale niezużywające się w jej trakcie. To zwiększenie efektywności zachodzenia przemian chemicznych nierzadko jest ogromne, naturalne katalizatory potrafią skrócić czas reakcji z kilku lat do kilkunastu sekund.
Enzymy znajdują się we wszystkich przestrzeniach organizmu: w komórkach, przestrzeni pozakomórkowej, w tkankach, w narządach i w ich świetle, to jakie katalizatory dana tkanka produkuje, decyduje o jej specyficznych właściwościach i o roli, jaką pełni w organizmie.
Większość enzymów jest bardzo specyficzna, oznacza to, że każdy z nich odpowiada tylko za jeden rodzaj reakcji chemicznej, w którą zaangażowane są konkretne cząstki - substraty i tylko one mogą współdziałać z danym enzymem.
Aktywność naturalnych katalizatorów zależy od wielu czynników: środowiska reakcji, np.: temperatury, pH, obecności niektórych jonów, aktywatorów - potęgują one działanie enzymów oraz inhibitorów, które tę aktywność znoszą.
Enzymy: budowa
Jak wspomniano, większość enzymów to białka, mają one bardzo zróżnicowaną budowę: od kilkudziesięciu aminokwasów do kilku tysięcy ułożonych w różnorodnej strukturze przestrzennej.
To forma ich ukształtowania (tak zwana struktura czwartorzędowa) oraz fakt, że większość enzymów jest dużo większa od substratów swoich reakcji odpowiada w dużej mierze za ich aktywność.
Wynika to z faktu, że w budowie enzymów tylko pewien określony rejon, jest tak zwanym miejscem aktywnym, czyli fragmentem odpowiadającym za przeprowadzenie reakcji.
Zadanie pozostałych fragmentów cząsteczki polega na przyłączeniu określonego substratu, rzadziej innych związków wpływających na aktywność enzymu.
Warto wiedzieć, że budowa katalizatora zaprojektowana jest tak, aby przyłączający się substrat był idealnie dopasowany geometrycznie, jak "klucz do zamka".
Jak wszystkie białka, enzymy produkowane są w rybosomach na podstawie zwartego w jądrze materiału genetycznego - DNA, w ten sposób powstaje tak zwana struktura pierwszorzędowa.
Następnie ulega ona kilkukrotnemu fałdowaniu - zmianie ukształtowania, niekiedy przyłączeniu cukrów, jonów metali, czy reszt tłuszczowych.
Skutkiem wszystkich tych procesów jest powstanie aktywnej struktury czwartorzędowej, czyli formy w pełni aktywnej biologicznie.
W wielu przypadkach kilka cząstek enzymów łączy się ze sobą, aby przeprowadzić ciąg reakcji chemicznych, a przez to przyspieszyć zachodzenie procesu.
Zdarza się, że w kilku tkankach występują enzymy, które katalizują tę samą reakcję, ale strukturalnie nie zawsze są do siebie podobne, nazywamy je izoenzymami.
Nazwy izoenzymów są takie same, mimo różnicy w lokalizacji oraz w budowie, te rozbieżności mają jednak zastosowanie praktyczne. Można dzięki temu oznaczać w badaniach laboratoryjnych tylko te frakcje enzymu, które pochodzą z określonego narządu.
Mechanizmy działania enzymów są różnorodne, ale z chemicznego punktu widzenia ich zadanie zawsze sprowadza się do obniżenia energii aktywacji reakcji. Jest to ilość energii jaką muszą posiadać substraty, aby doszło do zajścia procesu.
Efekt ten można osiągnąć poprzez stworzenie odpowiedniego środowiska do przeprowadzenia reakcji, wykorzystanie innego szlaku chemicznego do uzyskania tych samych produktów, czy odpowiednie ułożenie przestrzenne substratów.
Każdy z tych mechanizmów może być wykorzystywany przez enzymy.
Regulacja aktywności enzymów
Działanie enzymów zależy od parametrów środowiska: temperatury, pH i innych. Każdy z naturalnych katalizatorów ma swoje optimum działania w określonych warunkach, które może być różnie szerokie w zależności od jego tolerancji na warunki otoczenia.
W przypadku temperatury większość reakcji enzymatycznych przebiega szybciej przy wyższej temperaturze, ale przy pewnej jej wartości efektywność reakcji gwałtownie spada, co jest spowodowane termicznym uszkodzeniem enzymu (denaturacją).
Pod względem budowy hormony podzielić można na dwie grupy:
- proste - są to cząstki wyłącznie białkowe
- złożone - które do swojej aktywności wymagają przyłączenia grupy niebiałkowej - kofaktora
Te ostatnie pełnią kluczową rolę w odpowiedniej aktywności i regulowaniu działania enzymów.
Kofaktory z kolei można podzielić na dwie grupy: te niezbędne do działania enzymu, silnie z nim związane - są to tak zwane grupy prostetyczne, mogą nimi być metale, cząsteczki organiczne, jak np. hem.
Druga grupa to koenzymy, są one zwykle odpowiedzialne za przenoszenie substratów, czy elektronów, a ich wiązanie z enzymem jest słabe, do tej grupy należą np. kwas foliowy, koenzym A. Warto wiedzieć, że wiele witamin spełnia właśnie rolę kofaktorów.
Całkowicie odmienne zadanie pełnią inhibitory, są to cząstki hamujące aktywność enzymatyczną wiążąc się z enzymem.
Istnieje kilka typów inhibitorów:
- nieodwracalne - powodują one trwałą dezaktywację cząsteczki i reakcja będzie mogła zachodzić dopiero po wyprodukowaniu nowego enzymu
- kompetycyjne - w tym wypadku inhibitor ma podobną budowę do substratu, przez co konkurują one o miejsce aktywne. Jeśli przyłączony zostaje inhibitor reakcja nie zachodzi, jeśli substrat - przebiega normalnie
- niekompetycyjne - inhibitory takie wiążą enzym w miejscu innym niż przyłącza się substrat, a więc może on przyłączyć się do enzymu, ale reakcja nie zachodzi
Przy dużo większym stężeniu substratu niż inhibitora, działanie inhibitora kompetycyjnego zostaje przezwyciężone, ponieważ przerasta on "konkurencję" o miejsce aktywne, w przypadku niekompetycyjnego, jego działania nie można przezwyciężyć przez zwiększanie stężenia substratu.
Poza regulacją w układzie aktywatorów i inhibitorów istnieje wiele innych metod kontroli działania enzymów.
Dotyczą one sterowania przez komórkę produkcją na poziomie tworzenia białek, a także regulacji tak zwanej obróbki posttranslacyjnej, czyli zmian budowy cząsteczki białkowej zachodzących bezpośrednio po jej zsyntetyzowaniu w rybosomie. Te modyfikacje polegają np. na skracaniu łańcucha polipeptydowego.
Kolejne metody regulacji dotyczą segregacji i umieszczania enzymów w odpowiednich obszarach: komórkowym i w określonych organellach, czy w przedziale pozakomórkowym.
Istnieje jeszcze jeden istotny mechanizm regulacyjny -sprzężenie zwrotne ujemne - jest to podstawowy system sterowania w układzie hormonalnym. Działa na zasadzie inhibicji.
Oznacza to, że jeśli enzym produkuje zbyt dużo określonego hormonu, to wiąże się on z nim powodując zahamowanie aktywności i zmniejszenie syntezy, a więc sam produkt reakcji hamuje swoje wytwarzanie.
Enzymy: rola
Każda z tkanek ciała człowieka produkuje swoisty dla siebie zestaw enzymów, definiuje to rolę tych komórek, jakie odgrywają w funkcjonowaniu organizmu. Jakie są to enzymy definiuje kod genetyczny oraz to które jego regiony są w określonej komórce aktywne.
W ciele człowieka w każdej chwili zachodzi tysiące reakcji chemicznych, z których każda wymaga charakterystycznego dla siebie enzymu, dlatego trudno byłoby wymienić wszystkie te cząstki obecne w naszym organizmie.
Warto jednak wiedzieć o kilku najbardziej charakterystycznych:
- Enzymy trawienne - produkowane są przez tkanki układu pokarmowego, powodują rozkład pożywienia na proste związki, ponieważ tylko takie mogą być wchłonięte do krwi. Są to enzymy pozakomórkowe, czyli główne ich zadanie wypełniają poza komórkami, w których są produkowane. Część z tych enzymów powstaje w postaci nieaktywnej, tak zwanych proenzymów lub zymogenów, a aktywacji ulegają w przewodzie pokarmowym. Do enzymów trawiennych należą np.: amylaza, lipaza, trypsyna.
- Miozyna to enzym występujący w mięśniach, rozkłada on cząsteczki ATP będące nośnikami energii, dzięki czemu powoduje skurcz włókien mięśniowych.
- Peroksydazy to enzymy utleniające i katalazy, czyli enzymy redukujące
- Acetylocholinoesteraza to enzym rozkładający acetylocholinę jeden z przekaźników w układzie nerwowym
- Monoaminooksydaza to enzym obecny w największej ilości w wątrobie, odpowiada on za rozkład adrenaliny, noradrenaliny i niektórych leków
- Oksydaza cytochomowa, bardzo istotny wewnątrzkomórkowy enzym opowiadający za przemiany energetyczne
- Lizozym, czyli obecna np. w łzach czy ślinie substancja spełniająca funkcje ochronne, niszczy patogeny
- Dehydrogenaza alkoholowa, obecny w wątrobie enzym odpowiedzialny za rozkład etanolu
- Fosfataza alkaliczna, współuczestniczy w budowaniu kości przez osteoblasty
Enzymy: nazewnictwo
Nazwy enzymów często są dość skomplikowane, ponieważ pochodzą one od nazwy reakcji jaką przeprowadzają oraz substratu biorącego udział w tej reakcji, np. dekarboksylaza 5-hydroksytryptofanu.
Zazwyczaj do ogólnej nazwy reakcji dodaje się przyrostek "-aza", a drugi człon nazwy enzymu tworzy nazwa związku, który tej reakcji ulega.
Zdarza się, że nazwa jest jednoczłonowa, pochodzi ona wtedy od substratu, np. laktaza (enzym rozkładający laktozę).
Rzadziej nazwy enzymów wywodzą się z ogólnego procesu zachodzącego przy ich udziale, np. gyraza DNA, czyli enzym odpowiedzialny za obracanie nici DNA.
Niektóre enzymy w końcu mają nazwy zwyczajowe, czy nadane przez ich odkrywcę, tak jest w przypadku pepsyny (rozkładającej białka w przewodzie pokarmowym), czy lizozymu (enzymu bakteriobójczego zawartego we łzach).
Jest także niewielka grupa enzymów restrykcyjnych, które odpowiadają za przecinanie nici DNA, w tym przypadku nazwa pochodzi od mikroorganizmu, od którego enzym ten wyizolowano.
Międzynarodowa Unia Biochemii i Biologii Molekularnej wprowadziła zasady nazewnictwa enzymów oraz podzieliła je na kilka klas w celu ujednolicenia nazewnictwa.
Nie wyparło to opisanych wcześniej nazw, jest raczej ich uzupełnieniem stosowanym przede wszystkim przez naukowców.
Zgodnie z regułami Unii każdy enzym opisany jest przez ciąg znaków: EC x.xx.xx.xx - gdzie pierwsza cyfra oznacza klasę, kolejne podklasy i podpodklasy i w końcu numer enzymu. Wspomniane klasy enzymów to:
• 1 - oksydoreduktazy: katalizują reakcje utleniania i redukcji
• 2 - transferazy: przenoszą grupy funkcyjne (np. fosforanową)
• 3 - hydrolazy: odpowiadają hydrolizę (rozkład) wiązań
• 4 - liazy: rozcinają wiązania w innym mechanizmie niż hydroliza
• 5 - izomerazy: odpowiadają za zmiany przestrzenne cząsteczek
• 6 - ligazy: łączą cząsteczki wiązaniami kowalencyjnymi
Enzymy a medycyna
Znaczenie enzymów dla ludzkiego zdrowia jest ogromne. Ich prawidłowe działanie umożliwia życie w zdrowiu, a dzięki rozwojowi urządzeń analitycznych nauczyliśmy się, przy pomocy oznaczania enzymów diagnozować różne choroby. Co więcej niedobory niektórych enzymów i wynikające z tego choroby potrafimy z powodzeniem leczyć, niestety w tej kwestii dużo jest jeszcze do zrobienia.
Leczenie przyczyn chorób metabolicznych na chwilę obecną jest jeszcze niemożliwe, ponieważ nie potrafimy w sposób bezpieczny i skuteczny modyfikować materiału genetycznego, tak aby naprawić uszkodzone geny, a co za tym idzie nieprawidłowo wyprodukowane enzymy.
Choroby wynikające z dysfunkcjonalnych enzymów
Stan prawidłowego funkcjonowania naszego organizmu zależy w dużej mierze od prawidłowego działania enzymów. W wielu przypadkach stany chorobowe wpływają na ilość enzymów, powodując nadmierne ich uwalnianie z komórek lub wręcz przeciwnie - ich niedobór. Poniżej podano jedynie przykłady chorób spowodowanych nieprawidłowymi funkcjami enzymatycznymi, schorzeń tych jest dużo więcej.
- Bloki metaboliczne albo choroby metaboliczne
Bloki metaboliczne albo choroby metaboliczne to grupa chorób wrodzonych spowodowanych gromadzeniem się substancji w komórce na skutek braku enzymu odpowiedzialnego za ich metabolizm. Nagromadzonych z czasem substratów jest tak dużo, że stają się one toksyczne dla komórek i całego organizmu.
Schorzeń tych jest kilka tysięcy, ich liczba odzwierciedla mnogość enzymów występujących w ludzkim ciele, ponieważ choroby metaboliczne mogą dotyczyć większości genów kodujących enzymy.
Przykładami są galaktozemia czy homocystynuria, czyli choroby występujące rzadko, najczęściej objawiające się tuż po urodzeniu lub w pierwszych latach życia.
- Nowotwory
Kolejna grupa chorób, w powstanie których zaangażowane może być niewłaściwe działanie enzymów, to nowotwory. Poza wieloma innymi funkcjami enzymy są także odpowiedzialne za regulację podziałów komórkowych, są to tak zwane kinazy tyrozynowe. Jeśli w tym obszarze wspomniane enzymy zawiodą, może dojść do niekontrolowanego dzielenia się komórki, a więc procesu nowotworowego.
- Rozedma płuc
Rzadziej spotykaną chorobą jest rozedma płuc, w tym wypadku dochodzi do nadaktywności elastazy. Jest to enzym obecny w tkance płuc odpowiadający za rozkład białka elastyny obecnego między innymi w płucach właśnie.
Jeżeli jego aktywność jest zbyt duża, równowaga między niszczeniem a budowaniem zostaje zachwiana, dochodzi do bliznowacenia i rozwija się rozedma.
Enzymy: wykorzystanie w diagnostyce
Współczesna diagnostyka medyczna opiera się na wykorzystaniu w swoich oznaczeniach enzymów właśnie. Wynika to z faktu, że stany chorobowe bezpośrednio lub pośrednio prowadzą do zachwiania równowagi enzymatycznej powodując wzrosty lub spadki ich ilości we krwi.
Wynikać to może nie tylko z zaburzeń produkcji, ale też np. z uwolnienia do krwi czy moczu dużej ilości enzymu wewnątrzkomórkowego na skutek uszkodzenia jej błony komórkowej.
Przykładami enzymów wykorzystywanych w badaniach laboratoryjnych są:
- Kinaza kreatynowa - enzym obecny w mięśniach, również w mięśniu sercowym, jego kilkukrotny wzrost może świadczyć o zawale, zapaleniu mięśnia sercowego, chorobach mięśni - urazach, dystrofii.
- Dehydrogenaza mleczanowa - obecna we wszystkich komórkach organizmu, szczególnie w mózgu, płucach, białych krwinkach, czy w mięśniach. Jej duży wzrost obserwujemy w zawale serca, chorobach mięśni, wątroby, czy nowotworach.
- Fosfataza alkaliczna, w największej ilości znajduje się w wątrobie i w kościach, tu uwalniana jest przez osteoblasty. Choroby tych narządów mogą powodować jej wzrost, ale nadmiar fosfatazy alkalicznej świadczyć może także o procesie regeneracyjnym kości - po zabiegach, czy po złamaniu.
- Fosfataza kwaśna występuje w wielu narządach - wątrobie, nerkach, kościach, sterczu, z punktu widzenia diagnostycznego jej wzrost świadczyć może o chorobach kości i stercza właśnie.
- Aminotransferaza asparaginowa i aminotransferaza alaninowa - są to enzymy charakterystyczne dla wątroby występujące prawie wyłącznie w hepatocytach, są one wykorzystywane w podstawowej, skrinnigowej diagnostyce chorób wątroby, a kilkukrotne wzrosty ich wartości zawsze skłaniają do dalszej diagnostyki chorób tego narządu.
- Dehydrogenaza glutaminianowa i gammaglutamylotransferaza – kolejne enzymy wątrobowe, podobnie jak wcześniej wymienione są istotne w diagnostyce chorób tego narządu oraz dróg żółciowych.
- Amylaza to enzym obecny w wielu narządach, ale największe stężenie osiąga w komórkach trzustki i ślinianek, to w ich chorobach jego diagnostyka ma największe znaczenie.
- Lipaza to kolejny enzym trzustkowy, od amylazy różni się swoistością, oznacza to, że lipaza występuje wyłącznie w trzustce i odchylenia od normy w oznaczeniu tego enzymu świadczą o chorobie trzustki właśnie.
- Cholinesteraza jest to enzym rozkładający acetylocholinę - przekaźnik w układzie nerwowym, tam też występuje on w największej ilości, w diagnostyce wykorzystywany jest on w zatruciach związkami fosforoorganicznymi.
- Czynniki krzepnięcia i fibrynolizy - są to substancje produkowane przez wątrobę biorące udział w krzepnięciu krwi, ich oznaczenia są istotne nie tylko w ocenie tego procesu, ale także w monitorowaniu funkcji wątroby.
- Alfa-fetoproteina - enzym wątrobowy, którego ilość wzrasta w chorobach tego narządu, w tym w nowotworach.
- Białko C-reaktywne - produkowane przez wątrobę, biorące udział w odpowiedzi immunologicznej, jego ilość wzrasta we krwi w stanach zapalnych - infekcjach, urazach, chorobach autoimmunologicznych.
- Ceruloplazmina - kolejny enzym wątrobowy, którego wzrost jest charakterystyczny dla choroby Wilsona.
- Pirydynolina i deoksypirydynolina to marker resorpcji (niszczenia) kości, charakteryzują one czynność osteoklastów (komórek kościotwórczych).
- Mioglobina - jak wspomniano wcześniej, jest to związek charakterystyczny dla mięśni, a więc jego wzrost będzie świadczył o uszkodzeniu mięśni szkieletowych lub sercowego.
- Troponiny - tak zwane markery zawału serca, są to enzymy regulujące skurcz włókien mięśniowych, szczególnie obficie występują one w mięśniu sercowym. Jego uszkodzenie powoduje uwolnienie do krwi dużych ilości troponin, co jest wykorzystywane w diagnostyce chorób serca. Warto jednak pamiętać, że wzrost troponin może świadczyć nie tylko o zawale, ale także o jego niewydolności, wadach zastawkowych czy zatorowości płucnej.
Wszystkie wymienione wyżej enzymy można przyporządkować do kilku grup:
- enzymy sekrecyjne - diagnostyczna jest dolna granica normy. Są to enzymy fizjologicznie produkowane przez narządy, natomiast w przypadku chorób ich ilość spada, np. czynniki krzepnięcia
- enzymy wskaźnikowe - istotny jest wzrost. Ta grupa enzymów pojawia się w dużych ilościach na skutek uszkodzenia narządu i wycieku enzymu, należą do nich np. troponiny
- enzymy wydalnicze – są to enzymy produkowane normalnie do światła różnych narządów -jamy ustnej, jelit czy dróg moczowych. W przypadku zablokowania ich ujścia przedostają się do krwi, np. amylaza
Warto pamiętać, że w samej diagnostyce medycznej wykorzystywane są enzymy. Analizy biochemiczne wykonywane są przy pomocy enzymów, a odpowiednia interpretacja wyników reakcji enzymatycznych pozwala podać wynik badania laboratoryjnego.
Enzymy, a leczenie
Wiele leków działa poprzez wpływ na działanie enzymów właśnie, powodując pobudzenie ich działania lub wręcz przeciwnie - będąc inhibitorami. Istnieją leki będące substytutami enzymów, np. pankreatyna zawierająca lipazę i amylazę stosowana w niewydolności trzustki.
Z drugiej strony pewne grupy leków hamują działanie enzymów, np. inhibitory konwertazy angiotensyny stosowane między innymi w nadciśnieniu i niewydolności serca, czy niektóre antybiotyki, np. amoksycylina, która hamuje enzym transpeptydazę bakteryjną, co uniemożliwia budowanie ściany komórkowej bakterii, a skutkiem tego jest zahamowanie infekcji.
Niektóre trucizny również działają poprzez wpływ na enzymy. Cyjanek jest silnym inhibitorem oksydazy cytochromowej, istotnego składnika łańcucha oddechowego. Jego zablokowanie uniemożliwia uzyskiwanie energii przez komórkę, co prowadzi do jej śmierci.
Do prawidłowego przebiegu procesów życiowych komórek konieczne jest występowanie wielu substancji chemicznych, pozostających miedzy sobą w ścisłych proporcjach i między którymi nieustannie dochodzi do reakcji chemicznych.
Zadanie to spełniają prawidłowo działające enzymy, które są niezbędne do zajścia niemalże każdej reakcji chemicznej z szybkością i wydajnością konieczną dla właściwego funkcjonowania ciała człowieka.
Działanie enzymów przyspiesza zachodzenie tych procesów wielokrotnie, nierzadko nawet setki razy, co istotne same enzymy nie zużywają się w czasie zachodzących reakcji.
Niedobór katalizatorów lub ich niewłaściwe działanie może skutkować pojawieniem się wielu chorób. Z drugiej strony umiejętne modyfikowanie ich aktywnością pozwala z powodzeniem leczyć wiele przypadłości.
Enzymologia (nauka o enzymach) jest niezwykle rozległa, a jej rozwój przynieść może nie tylko postęp naukowy, ale także czynnie przyczynić się do rozwoju medycyny w zakresie nie tylko leczenia, ale i diagnostyki.